MIEMBROS DEL PANEL
Arne Ljungqvist (Suecia)
Presidente, Comisión médica del COI
Martin Schwellnus (Sudáfrica)
Profesor de Ciencia y Medicina deportivas, Universidad de Cape Town
Coordinador, Comisión médica del COI
Norbert Bachl (Austria)
Decano, Profesor de Fisiología del Ejercicio, Universidad de Viena
Coordinador, Comisión médica del COI
Malcolm Collins (Sudáfrica)
Científico especialista, Consejo de Investigación Médica de Sudáfrica
Jill Cook (Australia)
Profesor adjunto, Universidad La Trobe, Universidad de Deakin, Melbourne
Karim Khan (Canadá)
Profesor adjunto, Universidad de British Columbia, Vancouver
Nicola Maffulli (Reino Unido)
Profesor de Traumatología y Ortopedia, Escuela Universitaria de Medicina de Keele, Stoke on Trent, Reino Unido
Yannis Pitsiladis (Reino Unido)
Profesor adjunto de Fisiología del Ejercicio, Instituto de ciencias biológicas y biomédicas, Universidad de Glasgow
Graham Riley (Reino Unido)
Investigador principal, Campaña de Investigación de la Artritis, Universidad de East Anglia, Norwich
Geoffrey Golspink (Reino Unido)
Profesor, Royal Free y Escuela médica universitaria, Londres
Deon Venter (Australia)
Codirector de Patología, Mater Health Services, Brisbane, Profesor de Patología, Universidad de Queensland
Wayne Derman (Sudáfrica)
Profesor adjunto, Medicina y Ciencias deportivas, Universidad de Cape Town
Lars Engebretsen (Noruega)
Presidente, Centro ortopédico, Universidad de Oslo
Piero Volpi (Italia)
Doctor en Medicina, Instituto de Investigación y Tratamiento del Cáncer-Instituto Ortopédico Galeazzi, Milán
INTRODUCCIÓN
Se estima que se producen alrededor de 100 millones de lesiones musculoesqueléticas (tendón/músculo/hueso) al año en el mundo entero, de las cuales entre el 30 y el 50% son lesiones de ligamentos y tendones, causantes de una bajada significativa en el rendimiento deportivo y una disminución de la capacidad funcional en el lugar de trabajo, que tienen un impacto negativo en la capacidad de los miembros de la población general para practicar ejercicio. El tratamiento de una gran parte de estas lesiones resulta complicado y muchas personas presentan dolor y molestias a largo plazo.
El Comité Olímpico Internacional (COI) reunió recientemente a un grupo de expertos para debatir acerca de la naturaleza del problema, el estado actual de la técnica y la necesidad de realizar más investigaciones. Los recientes avances en este campo hacen referencia a: a) el descubrimiento de nuevos marcadores genéticos que pueden causar lesiones de tendón; b) la mayor comprensión de la estructura y la composición de los tendones y su respuesta a la sobrecarga; c) el incremento del uso clínico de factores de crecimiento a fin de tratar una variedad de lesiones tendinosas, óseas y musculares, y d) la investigación de análisis de la posibilidad de aplicación de las células troncales en pacientes con problemas musculoesqueléticos. En esta declaración de consenso se trata de forma detallada cada uno de estos avances.
PREDISPOSICIÓN GENÉTICA PARA PADECER LESIONES MUSCULOESQUELÉTICAS
Las lesiones musculoesqueléticas se producen por causas complejas, entre las que se incluyen tanto los factores genéticos como los no genéticos. La investigación de genes que puedan predisponer a los atletas a padecer estas lesiones está cobrando fuerza, aunque sigue estando en pañales. Por ejemplo, recientemente se descubrió que las variantes en 2 genes (que producen colágeno V y tenascina C) están asociadas con el dolor del tendón de Aquiles. Se requieren muchos estudios realizados en varios grupos de población y con tecnologías de alto rendimiento como la genómica y la proteómica a fin de realizar progresos en el conocimiento de las asociaciones genéticas con las lesiones musculoesqueléticas. Esto permitirá a los investigadores identificar más genes que puedan asociarse a estas lesiones y a otras que sean específicamente musculoesqueléticas. La capacidad para identificar las personas en riesgo en relación con estas lesiones se ampliará a la población general, donde la prevención de lesiones garantizará que la gente pueda realizar ejercicio de forma adecuada a su herencia de composición genética.
ESTRUCTURA Y COMPOSICIÓN DE LOS TENDONES Y SU RESPUESTA A LA SOBRECARGA
Cuando los atletas presentan dolor de tendones, ya están presentes las anomalías estructurales. Por lo general, desde la perspectiva del microscopio las células inflamatorias no suelen estar en el lugar de la lesión. Por ello, el término "tendinitis" ha perdido popularidad. El tendón lesionado presenta varios rasgos característicos, como la mayor o menor celularidad y una acusada alteración de la composición y estructura de la matriz. Se producen cambios cuantitativos y cualitativos en el colágeno, los proteoglucanos y las enzimas que degradan la matriz, así como una mayor penetración de los vasos sanguíneos y nervios. Un término clásico para describir este aspecto global ha sido el de "tendinosis", aunque las anteriores características se ajustan a una reparación inadecuada, es decir, una respuesta de cicatrización defectuosa.
Aunque la sobrecarga es importante para mantener la matriz normal del tendón, la patología en tendones suele asociarse al exceso de sobrecarga. El ejercicio puede incrementar la producción de colágeno y de otras proteínas en los tendones, de manera que puede utilizarse como parte del tratamiento de lesiones de tendón. Aunque las células tendinosas responden a la sobrecarga con un aumento de la producción de proteínas, en esa fase no queda claro qué estímulo es necesario para reestructurar una matriz dañada. La dolencia de tendones en fase final crónica puede conllevar no recuperar totalmente la estructura y composición matricial normal, aunque todavía pueda funcionar sin presencia de dolor.
INCREMENTO DEL USO CLÍNICO DE FACTORES DE CRECIMIENTO
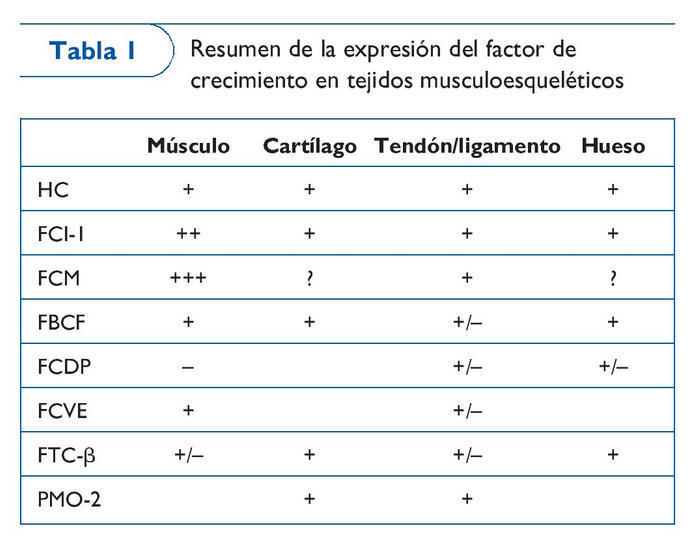
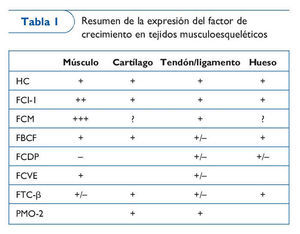
Los factores de crecimiento comprenden un número de proteínas secretadas por las células. Un gran número de estudios experimentales ha demostrado que los factores de crecimiento participan en la formación ósea y cartilaginosa, la cicatrización de fracturas, la reparación de ligamentos y tendones y la regeneración musculoesquelética. Por tanto, no resulta sorprendente que su uso terapéutico sea de enorme interés en el ámbito de la medicina deportiva y en el tratamiento de ayuda en las lesiones relacionadas con el lugar de trabajo. Entre los factores de crecimiento que interesan en la actualidad se incluyen la hormona del crecimiento (HC), el factor de crecimiento insulinoide-1 (FCI-1), el factor de crecimiento mecánico (FCM), el factor básico de crecimiento fibroblástico (FBCF), el factor de crecimiento derivado de las plaquetas (FCDP), el factor de crecimiento vascular endotelial (FCVE), el factor transformador del crecimiento-β (FTC-β) y la proteína morfogenética ósea (PMO) (tabla I). En la actualidad, algunos de estos factores de crecimiento se comercializan y utilizan de forma satisfactoria en entornos clínicos.
Las PMO han demostrado ser eficaces en diferentes fases del proceso de cicatrización ósea en varios modelos animales y humanos. Los FCVE, FCDP, FCF y FTC-β también han demostrado que desempeñan un papel importante en la cicatrización de ligamentos y tendones. Aunque en modelos animales existe un conjunto de pruebas de investigación, a excepción de las PMO, los resultados de estudios clínicos de fase tardía controlados de forma aleatoria realizados en seres humanos todavía no están disponibles y se desconocen los efectos sistémicos y locales a largo plazo de estos agentes. Los FCF, FTC-β y FCDP han demostrado su importancia en el proceso de regeneración muscular. Por su parte, se ha visto que el FCVE y el FCDP incrementan la irrigación sanguínea para los músculos esqueléticos. Sin embargo, la administración del FCVE para mejorar la transfusión sanguínea se investigó en otros estudios clínicos con unos resultados limitados, mientras que un ensayo de fase II del FCDP reveló efectos positivos en la irrigación sanguínea periférica.
La mayoría de las fracturas no cicatrizan de forma adecuada y, por tanto, todavía es necesario mejorar el proceso de cicatrización ósea. Hasta ahora, la proteína morfogenética ósea humana recombinante-2 (PMOrh-2) y la proteína morfogénetica ósea recombinante humana-7 (PMOrh-7) o la proteína osteogénica-1 (PO-1) se han utilizado en el ámbito clínico. En la actualidad se han publicado varios estudios clínicos acerca de los efectos de las PMO en la cicatrización ósea o en las fracturas consolidadas de forma tardía/fracturas no consolidadas y, asimismo, varios estudios han informado acerca de los efectos de la fusión de la columna lumbar, hasta el punto de que ahora éstos constituyen una práctica bien establecida de cirugía ortopédica.
La hormona del crecimiento, producida por la glándula pituitaria, induce al hígado a producir FCI-1 sistémico, que forma un complejo de unión triple con la proteína de unión del FCI tres (PUFCI-3) y la subunidad ácido lábil (SAL), a fin de estabilizar el FCI-1 en el suero. La HC y el FCI-1 alcanzan sus valores máximos en la adolescencia. Con más edad, no obstante, se produce un declive marcado de los valores circulantes de la HC y un declive algo menor del FCI-1 circulante. El tratamiento de adultos con valores insuficientes de HC durante un período prolongado de tiempo da lugar no sólo a un incremento de la fuerza de los músculos, sino también a un descenso de grasa corporal. Estos resultados han potenciado el uso ilícito de la HC y de sustancias similares a ella entre los atletas, incluso entre los que compiten a nivel de enseñanza secundaria, a fin de intentar mejorar el rendimiento. Esto suscita un problema constante para las agencias antidopaje. En la actualidad existen métodos para la detección de la HC y de las sustancias similares a ésta, así como de los FCI sistémicos. Sin embargo, la situación se complica con las formas locales del FCI-1, como el factor de crecimiento mecánico (FCM), que no se pueden detectar con los métodos actuales. El FCM se produce después del ejercicio por medio de la unión del gen del FCI-1 y posee diferentes secuencias en relación con el tipo sistémico de FCI-1. Se trata de un factor muy potente para incrementar la masa y la fuerza musculares. Al parecer, el FCM actúa como un factor de crecimiento independiente que participa en la activación de la proliferación de células satélites y el abastecimiento de reserva de estas células troncales musculares. En resumen, estos estudios modelos de animales han destacado algunos candidatos interesantes que esperan a la evaluación de los ensayos clínicos en seres humanos.
INVESTIGACIÓN DE ANÁLISIS DE LA POSIBILIDAD DE APLICACIÓN DE LAS CÉLULAS TRONCALES
Las células troncales mesenquimales (CTM) son células adultas que generan tejidos y que se han aislado de varias partes del cuerpo, como los cartílagos, la médula ósea, el sinovio, el tejido adiposo, los cartílagos articulares, los músculos y los tendones. En la actualidad, las CTM pueden utilizarse potencialmente para estrategias de ingeniería tisular a través de la implantación de matrices estructurales y geles, para la liberación de genes y para la producción del factor de crecimiento a fin de estimular la reparación tisular o inhibir la degradación de los tejidos. Mientras que la mayoría de estudios se han realizado en modelos animales, algunos realizados de huesos, cartílagos y tendones humanos han obtenido resultados positivos. Sin embargo, se garantizan otros ensayos clínicos controlados en lesiones musculoesqueléticas en seres humanos. Una de las razones por las que no se avanza en este ámbito reside en el hecho de poder encontrar los recursos óptimos de y los métodos para la diferenciación de células y el desarrollo de materiales y métodos de suministro quirúrgico óptimos. Aunque algunos estudios han obtenido efectos negativos, incluyendo la calcificación ectópica y el crecimiento excesivo de tejido conjuntivo, deberían realizarse más ensayos clínicos a fin de determinar si existen complicaciones a largo plazo.
POSIBLES LÍNEAS DE INVESTIGACIÓN FUTURAS EN LA TERAPIA DEL FACTOR DE CRECIMIENTO
La implementación de nuevas terapias biológicas basadas en la administración de factores de crecimiento y la manipulación de células troncales adultas requerirá una mejora de la comprensión de las redes genéticas reguladoras que se ven afectadas por estos agentes, algo necesario por dos razones: en primer lugar, a fin de garantizar que estas terapias se optimizan y, en segundo lugar, a fin de garantizar la seguridad del paciente/atleta. El conocimiento de los impactos genómicos y proteómicos de terapias basadas en el factor de crecimiento sobre las células diana y de los biomarcadores que reflejan el estado de diferenciación de las células troncales sustentará el desarrollo de pruebas capaces de controlar la eficacia terapéutica y minimizar los acontecimientos adversos.
POSIBILIDADES EN RELACIÓN CON EL ABUSO DE TERAPIAS BASADAS EN FACTORES DE CRECIMIENTO Y EN CÉLULAS
La capacidad para manipular las células troncales musculares y las células musculares existentes puede utilizarse en el contexto de mejora ilegal del rendimiento. El conocimiento de sucesos celulares y genéticos subyacentes en los que se ha impactado por la administración del factor de crecimiento puede utilizarse para desarrollar pruebas capaces de detectar el uso ilegal de dichas tecnologías para la mejora del rendimiento. El COI controlará los avances en este ámbito a fin de garantizar que dichas prácticas no se fomentan y que se detectan en caso de ser utilizadas a través del trabajo conjunto con las agencias antidopaje.
ASESORES CIENTÍFICOS
En la actualidad, el COI posee asesores científicos de alto nivel que son capaces de controlar nuevos avances en el ámbito de las terapias basadas en células y en el factor de crecimiento, y de asesorar a estos organismos en relación el uso y el abuso de estas tecnologías. Estos asesores ayudarán a garantizar que los atletas y entrenadores se beneficien de dichos avances al mejorar su capacidad para evitar lesiones y para mejorar la terapia en caso de lesión. Además, el uso ilegal de estas tecnologías en el ámbito de la mejora del rendimiento será cada vez más complicado a medida que se vaya disponiendo de dichos métodos de detección.
En caso de divergencias entre la versión en inglés y las versiones traducidas de la declaración de consenso, prevalecerá la versión en inglés.
Bibliografía
Chang H, Brown CW, Matzuk MM. Genetic analysis of the mammalian transforming growth factor-beta superfamily. Endocrine Reviews. 2002;23:787-823.
Goldspink G, Yang SY. The splicing of the IGF-1 gene to yield different growth factors. Advances in Genetics. 2004;52:23-47.
Haddad F, Adams GR. Selected contribution: Acute cellular and molecular responses to resistance exercise. Journal of Applied Physiology. 2003;93:394-403.
Kim HJ, Jang SY, Park JI, Byun J, Kim DI, Do YS, et al. Vascular endothelial growth factor-induced angiogenic gene therapy in patients with peripheral artery disease. Experimental and Molecular Medicine. 2004;36:336-44.
Kjaer M. Role of extracellular matrix in adaptation of tendon and skeletal muscle to mechanical loading. Physiology Review. 2004;84:649-98.
Krampera M, Pizzolo G, Aprili G, Franchini M. Mesenchymal stem cells for bone, cartilage, tendon and skeletal muscle repair. Bone. 2006;39:678-83.
Lian O, Scott A, Engebretsen L, et al. Excessive apoptosis in patella tendinopathy in athletes. American Journal of Sports Medicine. Tendon and skeletal muscle repair. Bone. 2007;39: 78-83.
Maffulli N, Renström P, Leadbetter W. Tendon injuries: Basic and clinical aspect. London: Springer Verlag; 2005. p. 1-252.
Nordsletten L, Madsen JE. The effect of bone morphogenetic proteins in fracture healing. Scandinavian Journal of Surgery. 2006; 95:1-4.
Riley G. The pathogenesis of tendinopathy. A molecular perspective. Rheumatology. 2003;42:1-14.
September AV, Schwellnus MP, Collins M. Tendon and ligament injuries: The genetic component. British Journal of Sports Medicine 2007;41:241-6.
Woo SL-Y, Renström P, Arnoczky SP. Tendinopathy in athletes. IOC Medical Commission Publication. Blackwell Publishing; 2007.