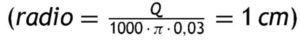La función de amortiguación de las oscilaciones de la presión de la sangre hace de la aorta una «prolongación» de la función ventricular sistólica. Esta función se pone aún más de manifiesto durante el ejercicio de resistencia, durante el cual se produce un incremento del índice de eyección de unas 4 veces los valores de reposo. De la misma manera que a consecuencia del entrenamiento se produce una adaptación de la morfología cardiaca, la aorta experimenta una modificación de su estructura que permite una mejor función amortiguadora. Los deportistas que mayor grado de adaptación pueden experimentar, tanto de las cavidades cardiacas como de la aorta, son aquellos que demandan una elevada exigencia cardiovascular, alto componente dinámico y moderado estático. En seres humanos, mediante medidas incruentas (ecocardiografía, resonancia magnética, fundamentalmente), se ha demostrado un incremento del tamaño de la aorta en los deportistas con mayor exigencia cardiovascular.
The damping of the blood pressure oscillations makes the aorta an ‘‘extension’’ of the ventricular systolic function. This function is even more evident during endurance exercise, with an increase in the ejection index of 4 times the resting values. Similarly, as a result of training, an adaptation occurs in cardiac morphology, in which the aorta undergoes a change in its structure that allows for better damping function. Athletes that adapt more may experience both of the heart chambers and the aorta, are those who demand a high cardiovascular stress, a high dynamic component and moderate static component. By using non-invasive measurements in humans (mainly echocardiography and MRI), the size of the aorta has been shown to increase in athletes with greater cardiovascular demands.
Introducción
La aorta tiene 3 claras funciones. La más intuitiva es «la conducción periférica» de la sangre (función de conducción), propulsada «centralmente» por el ventrículo izquierdo. La segunda es la de constituir un «almacén temporal» de sangre (función de reservorio) durante el periodo en el que el ventrículo izquierdo se relaja y distiende para admitir la sangre procedente del territorio venoso. La tercera es la de «convertir» un «flujo pulsátil» en un flujo casi estable en los vasos periféricos, «amortiguando las oscilaciones de presión de la sangre» (función de protección)1. Esta última función es trascendental, pues se ha estimado que el cambio de volumen en la aorta durante el ciclo cardiaco puede ser estimado en 12,5 ml asumiendo una presión del pulso de 25 mmHg y una distensibilidad de 0,5 ml/mmHg1.
La capacidad de reservorio permite realizar un cambio de volumen considerable en todo el árbol arterial con cambios muy pequeños de presión. Si la aorta no fuera «elástica» o bien perdiera su elasticidad, como así ocurre con la edad, hecho comprobado desde hace tiempo2-4 y en la actualidad5-10, la presión tan elevada ejercida por el ventrículo izquierdo podría limitar el vaciado y la presión en la aorta caería tan rápidamente que no se podría llenar el ventrículo durante la diástole con los valores de presión normales en la aurícula izquierda.
Los objetivos de esta revisión se llevarán a cabo desde una perspectiva fisiológica y son los siguientes:
1. Describir las propiedades mecánicas de la aorta que tienen su base en las características de las capas del vaso. La compresión del comportamiento mecánico de la aorta puede servir para justificar el proceso de adaptación o no de la aorta en deportistas con una alta exigencia cardiovascular.
2. Revisar y analizar si, a consecuencia de realizar ejercicio exigente para el sistema cardiovascular, se produce o no un proceso de adaptación en la aorta. Durante el ejercicio intenso se producen considerables oscilaciones en la presión, de manera que es coherente pensar que la aorta pudiera modificar su estructura y, como consecuencia, su comportamiento mecánico haciéndose más eficiente.
Propiedades mecánicas de la aorta
El aumento de presión durante toda la fase isovolumétrica y el vaciado rápido determina que la aorta debe maximizar el radio y así descender la resistencia al flujo. De esta forma el flujo debe ser lo más laminar posible procurando no alcanzar un valor del número Reynolds próximo a 1.000, que daría lugar a turbulencia. Por tanto, el radio de la aorta debería ser proporcional al gasto cardiaco y la constante de proporcionalidad vendría dada por la siguiente ecuación (K = σ/η · Re · π, siendoη la viscosidad de la sangre y σ la densidad). Con un valor de viscosidad de la sangre próximo a 0,03 cm2/s, el radio de la aorta debería ser el resultado de multiplicar este valor por el gasto cardiaco
Sin embargo, aunque este valor teórico se corresponde con las medidas realizadas11,12 para la mayor parte de las especies animales estudiadas, el valor predictivo es bajo, siendo inferiores para animales pequeños y superiores en animales de mayor tamaño. No obstante, la corrección para la superficie corporal (área aorta = SC0,72) ajusta en mayor medida la relación de proporcionalidad entre el gasto cardiaco y el área de la aorta, si bien, como la duración de la sístole varía inversamente con la raíz cuadrada de la frecuencia de pulso, la velocidad lineal de la sangre durante la sístole es mayor en los animales pequeños. Esto significaría que los animales pequeños gastan relativamente más energía que los grandes11,12 para la misma sección transversal de la aorta y gasto cardiaco relativo al tamaño.
La estructura de la pared de la aorta como justificación de las propiedades mecánicas
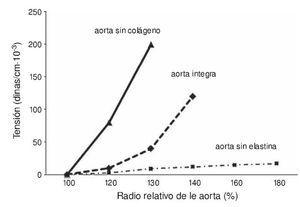
Actualmente, se considera que muchas de las estructuras de la pared arterial están interconectadas y no forman parte exclusiva de cada una de las capas, de tal manera que se ven influidas mutuamente. Se ha demostrado que las aortas en las que, mediante tratamiento químico, han eliminado el colágeno pero tienen fibras elásticas (fig. 1) muestran un incremento de su capacidad para distenderse no muy diferente de la observada en el rango más bajo de la relación longitud/tensión, correspondiente al vaso intacto.
Figura 1. Relación entre la tensión de la pared de la aorta y el radio relativo de la misma. Realización propia a partir de datos de la bibliografía: Shadwick RE. Mechanical design in arteries. J Experimen Biol. 1999;202(23):3305-3313.
Esto significaría que las fibras musculares lisas, de elastina y de colágeno estarían interrelacionadas formando una «red única» que funcionaran tanto en serie como en paralelo, de manera que la distensibilidad de la pared en conjunto sería el resultado no solo de las propiedades individuales de cada una de las fibras, sino de la interrelación entre estas13.
Por la especial relevancia que tiene para la compresión de las propiedades mecánicas de la aorta, a continuación se describen brevemente las capas de la pared de las arterias elásticas como la aorta13. Particularmente, las características de la capa media permiten explicar de alguna forma las propiedades mecánicas de las paredes de las arterias y cómo se pueden ver alteradas en determinadas patologías. Se han descrito 3 tipos fibrilina en el genoma humano y las mutaciones de la fibrilina i conducen al síndrome de Marfan, que se caracteriza por alteraciones cardiacas (dilatación de la raíz de la aorta) esqueléticas y oculares14. Mutaciones de la fibrilina ii se asocian a una enfermedad congénita autosómica dominante que cursa, entre otras anomalías, con alteraciones vasculares15. En animales, la deficiencia de fibulina desencadena alteraciones evidentes en el arco aórtico16. En el ser humano, las mutaciones del colágeno tipo i pueden conducir a una forma de enfermedad autosómica recesiva (síndrome de Ehlers-Danlos)17. Finalmente, se debe señalar que la función de otras proteínas (emilina-1, lisín-oxidasas) en las paredes de las arterias es desconocido13.
Características mecánicas de la aorta
Con preparaciones de anillos aórticos se ha demostrado que la relación entre la tensión (T = dF/dA ; siendo F la fuerza y Ala superfice o área) de la pared de la aorta y la longitud de la misma no guardan una relación lineal y que no obedece a la ley de Hook, sobre todo a partir de un rango18. Este autor estableció una analogía del comportamiento de la aorta al de un tubo de goma cubierto con un revestimiento relativamente rígido18. En la denominación actual stress (fuerza aplicada por unidad de superficie) y strain (variación de longitud respecto a un valor inicial) se relacionan como sigue:
donde Y es una constante (módulo de Young), que depende de la composición del material, A es el área de la sección transversal y T es la tensión ejercida para el material de longitud inicial (L0) y un cambio de longitud.
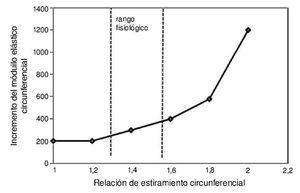
Características generales de la relación tensión/longitud. La aplicación de la ecuación 1 a la aorta conduce al comportamiento explicado por Remington y corroborado con posterioridad (fig. 2). Sin embargo, cuando se ha intentado explicar el comportamiento general en función de los 2 componentes principales de la pared de las arterias (elastina y colágeno) (fig. 1) se ha visto una variación en el módulo de Young. A valores bajos de tensión, el módulo elástico de la elastina domina el comportamiento mecánico de todo el conjunto de estructuras de la pared y esta es relativamente extensible13. A partir de cierto valor de longitud, la tensión experimentada aumenta de forma exponencial; un ligero incremento de longitud determina un considerable aumento de la tensión.
Figura 2. Relación entre el estiramiento circunferencial y el incremento del módulo de elasticidad circunferencial-Realización propia a partir de datos de la bibliografía (Wagenseil, JE and Mecham, RP. Vascular extracel·lular matrix and arterial mechanics Physiol Rev. 2009; 89(3):957.
La explicación dada por Wagenseil y Mecham13 es que, a grandes valores de tensión, la aorta también es distensible, pero no la elastina, sino el colágeno; de manera que para un valor determinado predominan las características del colágeno, pues la pared es relativamente inextensible. Como los vasos elásticos están sometidos a variaciones cíclicas de la presión, significa que estos se «expanden y contraen» con los cambios de presión. Esto evita que los vasos se encuentren sometidos a presiones muy elevadas. El comportamiento del vaso íntegro, sin colágeno o elastina, se muestra en la figura 1. Nótese cómo se desplaza la relación radio/tensión hacia el colágeno cuando la tensión es elevada y hacia la elastina cuando la tensión es baja. La aorta íntegra muestra un comportamiento medio, que del análisis de la figura se deduce que no es el resultado de una suma algebraica de los comportamientos cuando la pared está sin colágeno o sin elastina.
Modelos matemáticos relativos al comportamiento mecánico de la arteria. La relación no lineal hace complicada la descripción matemática de la relación tensión-longitud. Así, el estrés, a un valor determinado de longitud, puede ser calculado mediante una simple ecuación lineal cuando la relación se encuentra en el rango fisiológico, pero es necesario determinar las constantes para un comportamiento exponencial o polinómico cuando se supera el rango fisiológico. A pesar de las dificultades de establecer modelos matemáticos que expliquen la relación tensión/longitud, son necesarios para comparar entre especies animales diferentes y, sobre todo, en condiciones extremas como puede suceder durante el ejercicio. Es cierto que con las técnicas de imagen actual, si se conoce la relación longitud-tensión, se puede calcular la tensión y determinar la estabilidad de la pared del vaso que se predice13.
Los modelos matemáticos son complicados de llevar a cabo, pues es necesario tener presente que la relación tensión/longitud presenta, como muchas otras estructuras biológicas, el fenómeno de la histéresis (viscoelasticidad o seudoelasticidad). Esto significa que se debería considerar una relación tensión/longitud para cuando la aorta se distiende y otra durante el proceso de recuperación elástica. Se desconoce si el fenómeno de histéresis se «acumula» o no cuando se producen acciones repetidas de deformación. Cuando se produce el fenómeno de la histéresis es posible que los diferentes componentes de la pared arterial experimenten una reorganización en los planos circular y longitudinal. Es posible que si, en efecto, así fuera, sería muy importante de cara a conocer qué le pasa a la raíz de la aorta de los deportistas.
Presumiblemente, las descripciones matemáticas de la relación longitud-tensión constituyen ecuaciones cuyas constantes hacen referencia a las propiedades de los materiales. El problema radica en que es necesario realizar ciertas especificaciones a la hora de abordar la geometría de la arteria1: 1) conocer la longitud y diámetros de la aorta en todos sus segmentos, y 2) hay que tener en cuenta la transformación del flujo laminar a turbulento, para lo que hay que tener en cuenta una serie de parámetros dimensionales como son el número de Reynolds y el número Womerseley. No obstante, métodos de imagen sofisticados (resonancia magnética, tomografía computarizada, tomografía por emisión de positrones, ultrasonidos, microtomografía computarizada, tomografía óptica a nivel tisular, microscopia de interferencia, microscopia multifotón y tomografía electrónica a nivel celular y cristalografía de rayos x a nivel molecular) han permitido en la actualidad valorar los diferentes métodos matemáticos con relativa precisión. Alguna de estas modalidades ha sido utilizada para imagen de aorta1,19,20.
De forma simple, los modelos matemáticos con continuidad (métodos continuos) proponen que todos los componentes de la pared intervienen como un todo de manera que los cambios producidos en la pared del vaso se deben al conjunto. El inconveniente es que no tienen en cuenta los cambios que se pueden producir en los diferentes componentes de la pared. Consideran la pared un comportamiento viscoelástico o seudoelástico, lo que significa que los comportamientos en carga y descarga son tratados de forma separada. Los vasos son considerados no lineales, anisótropos (diferentes propiedades en diferentes direcciones) e incompresibles. Todos los modelos continuos describen razonablemente bien el comportamiento mecánico de la relación longitud-tensión1.
Los modelos sin continuidad (métodos microestructurales) asignan un comportamiento mecánico diferente a cada uno de los componentes de la pared con los límites sobre cómo se deforma uno respecto del otro y la arteria completa. Los cambios de composición modifican las propiedades del material de la arteria completa y conducen a mejorar los resultados en pacientes con enfermedad arterial periférica que son tratados con ramipril13. De forma general, estos modelos atribuyen diferentes comportamientos mecánicos a los siguientes componentes de la pared arterial: elastina (comportamiento lineal) y colágeno (comportamiento isotrópico no lineal y anisótropo).
Con independencia del modelo considerado, Kassab1 resume que, en general, la pared de los vasos puede modelarse o remodelarse en respuesta a los cambios de presión que se ejercen en el sistema arterial, de manera que la fuerza ejercida sobre la pared se puede mantener constante mediante los mecanismos de regulación sobre el diámetro de los vasos (constricción o dilatación). Otros investigadores sugieren que la presión de la sangre se encuentra en «oposición» a las propiedades de elastina, colágeno y fibras musculares lisas, las cuales se encuentran orientadas en capas, de forma que la tensión promedio de cada lamela es bastante constante (ΔL).
Adaptación de la aorta al entrenamiento
En deportistas, parece coherente pensar que la máxima expresión de adaptación aórtica sea en los corazones que experimentan un mayor grado de dilatación e hipertrofia, valoradas mediante ecocardiografía, dado que son los que someten a un elevado estrés a su sistema cardiovascular. En este sentido, son los deportistas que en sus entrenamientos y competición desarrollan un alto componente dinámico y moderado a alto componente estático, según la clasificación de Mitchell et al.21. Por este motivo, este epígrafe está enfocado a estos atletas.
Experimentación animal
Diversos estudios han abordado el análisis de las características mecánicas de las arterias no encontrando diferencias en el módulo de Young (distensibilidad arterial) en ratas entrenadas22 o bien este índice era menor en ratas entrenadas respecto a las sedentarias23. Sin embargo, el módulo de Young no demuestra que la distensibilidad aórtica (dV/dP) cambie, según argumentan Koutsis et al.24. Debido a la ley de Laplace, una modificación en el módulo de Young puede ser contrarrestada por una modificación del radio del vaso, como así sucede con el avance de la edad, donde un empeoramiento de la distensibilidad se compensa con un mayor diámetro de la aorta.
Koutsis et al.24 demostraron que, a consecuencia del entrenamiento, mejora la distensibilidad pasiva de la pared aórtica de las ratas entrenadas. Ciertamente la mejora fue significativa únicamente en el extremo superior de la relación entre la variación de longitud de la aorta en relación a la variación de tensión (ΔL/ΔT), L/T, es decir, situación difícil de alcanzar en condiciones in vivo. Las diferencias en la distensibilidad pasiva de la aorta entre ratas sedentarias y entrenadas eran debidas al aumento del colágeno en la capa media en ratas sedentarias lo que explicaría, particularmente, las diferencias en la velocidad de extensión observadas donde el colágeno se mantiene como factor principal de la rigidez. Tanto la cantidad de colágeno como la de elastina no eran menores en la capa media de las aortas de las ratas entrenadas respecto de las sedentarias. Finalmente, para conocer mejor la respuesta de la aorta al ejercicio, es importante determinar las diferencias de la respuesta de la tensión máxima al incremento de las catecolaminas, ya que durante el ejercicio se produce un incremento de la actividad simpático-adrenal. Los posibles cambios de la tensión máxima en ratas entrenadas respecto de las sedentarias podrían ser la consecuencia de: 1¿) una hipertrofia de las fibras musculares lisas de la pared de las arterias y 2¿) un menor número de recetores alfa-adrenergicos o bien a una menor sensibilidad de estos a la concentración de catecolaminas en general y de noradrenalina en particular. Estas posibles explicaciones están todavía por demostrar.
Seres humanos
Características hemodinámicas que repercuten en la posible adaptación de la aorta
El índice de eyección (volumen de eyección/superficie corporal) aumenta de unos 6-15 ml/m2 (en reposo) a 8-25 ml/m2 o en valores absolutos de 5-6 l/min a 25-40 l/min25,26. Estos datos sugieren un aumento de la presión ejercida por el ventrículo izquierdo. Medidas en animales o indirectas en seres humano (presión en la arteria braquial) sugieren lo que puede suceder en la aorta ascendente26. Se ha demostrado que la presión sistólica medida en el brazo es sobreestimada y que la presión media es similar en la aorta ascendente durante un ejercicio en cinta rodante27. De cualquier manera, aunque exista una diferencia entre los valores encontrados entre una arteria periférica y la aorta es obvio que se producen grandes oscilaciones «sostenidas» durante esfuerzos dinámicos, aunque pueden incluso ser más elevados en esfuerzos isométricos28.
Por otra parte, el trabajo realizado por el corazón durante el ejercicio debe de alcanzar valores que pudieran repercutir en la función de la aorta. El trabajo total cardiaco es la suma de: 1) el trabajo para desarrollar presión en la sangre y bombear un determinado volumen (Wlatido = presió n volumen); 2) la energía cinética Ec = ½m · v2, y 3) la energía desarrollada para generar tensión durante el periodo de contracción isovolumétrica Etensión = K · T ·Δt; siendo T la tensión de la pared ventricular y Δt que el ventrículo mantiene la tensión). Se considera que en reposo la Ec es prácticamente despreciable, pero que puede ser importante en ejercicio físico de alta intensidad, alcanzando hasta el 15%, cuando la velocidad de la sangre puede alcanzar valores que superen el número crítico de Reynolds. Durante el ejercicio, aún más importante puede ser el trabajo en cada latido y sobre todo la energía desarrollada en contracción isovolumétrica, donde se presume que se generan los valores más altos de presión.
Así, probablemente, los «valores más elevados de presión ventricular y el trabajo total desarrollado durante el ejercicio intenso» se obtengan en deportistas que tienen un componente dinámico muy elevado y un componente estático moderado según la clasificación de Mitchell et al.21.
Tamaño de la aorta como fenómeno de adaptación
Los límites superiores en el grado de dilatación e hipertrofia cardiacas se han demostrado en remeros y ciclistas en 2 de las series más grandes publicadas, 94729 y 4.73930. La tabla 1 muestra los datos del tamaño del ventrículo izquierdo, grosor de las paredes y tamaño de la aorta únicamente para los deportistas con elevada exigencia cardiovascular. Los valores admitidos para el diámetro de la aorta se han realizado en una dimensión (modo M), aunque en la actualidad se realizan a diferentes niveles en modo bidimensional. Teniendo en cuenta solo las medidas en modo M, es admitido por toda la comunidad científica que el diámetro de la aorta está aumentado en los atletas con gran exigencia cardiovascular respecto a los valores de normalidad determinados por Roman et al.31 y admitidos por las sociedades europea y americana de ecocardiografía.
En un estudio de metaanálisis32 la dimensión de la raíz de la aorta es mayor (2,2 mm) en los deportistas de resistencia que en los sedentarios, aunque estos autores consideran que el aumento del tamaño de la raíz aórtica es ligero, desde el punto de vista anatomo-funcional considero que es a tener en cuenta por las siguientes razones. En primer lugar, las diferencias de tamaño de la aorta entre deportistas y sedentarios son similares a los incrementos en el tamaño del ventrículo y grosores del miocardio, alrededor del 20%. En segundo lugar, es necesario tener presente que la raíz de la aorta se encuentra dentro del pericardio fibroso conjuntamente con la arteria pulmonar, de manera que hay una capacidad muy reducida para alcanzar el estiramiento. Por otra parte, la dilatación de la raíz de la aorta en deportistas es excepcional33, pues 17 de 2.317 deportistas italianos tenían unas dimensiones de la raíz de la aorta ≥ 99 percentil de la población estudiada (> 40 mm en lo varones y > 34 mm las mujeres).
Modificaciones a nivel ultraestructural a consecuencia del entrenamiento
Aunque las medidas de la aorta en deportistas de resistencia son claramente mayores que en sedentarios, la duda que se establece es conocer si este incremento es consecuencia de modificación morfofuncional de la pared aórtica. Como se ha señalado anteriormente, la experimentación animal parece confirmar una mejora de la distensibilidad pasiva de la aorta ascendente. Los diferentes estudios en seres humanos no demuestran indirectamente de forma unánime una mejora de las propiedades mecánicas de la aorta.
Burr et al. observaron que el ejercicio de ultrarresistencia podría provocar una alteración de la elasticidad arterial pero que era reversible34. Otros autores han demostrado evidencias relativas a que el entrenamiento de resistencia produce un descenso en la elasticidad arterial35-37 o bien no desencadena cambios38-40. Finalmente, diversos investigadores argumentan que el entrenamiento mejora las características mecánicas de las arterias41-47 o bien que induce cambios dependientes del tipo de entrenamiento48,49.
En general, los autores que indican una mejor adaptación de la aorta ha demostrado diferencias para la distensibilidad arterial en los deportistas de resistencia. Concretamente, D’Andrea et al.46 encontraron diferencias entre los deportistas de resistencia respecto de los de fuerza y controles (4,7, 2,8 y 3,1 en dyn−1 cm−2·10−6, para los deportistas de resistencia, fuerza y controles, respectivamente). El índice de rigidez calculado por D’Andrea et al.46 fue mayor en los deportistas de fuerza respecto de los de resistencia y sujetos controles (9,2, 6,9 y 6,6 es adimensional, pues la ecuación es aortic stiffness = ln(SBP/DBP)/[(AoS_AoD)/AoD], para los deportistas de fuerza, resistencia y controles, respectivamente). El aumento de rigidez en la aorta en los deportistas de fuerza lo atribuyen estos investigadores46 a la sobrecarga de presión que se debe de producir en este tipo de esfuerzos.
Debido a las considerables limitaciones metodológicas de los diferentes estudios que sostienen o no una mejora de las características mecánicas, lo cierto es que los resultados que encontraron son muy coherentes. Como se ha indicado anteriormente, parece lógico que en aquellos deportistas que tienen que bombear un volumen de sangre elevado, la aorta se vuelva más distensible y al mismo tiempo menos rígida, es decir, más elástica. Las variaciones en las propiedades mecánicas de la aorta propuestas se sostienen por el incremento de las concentraciones de los diferentes componentes (colágeno y elastina) de las paredes arteriales.
En resumen, existen evidencias científicas sobre la adaptación de la pared al entrenamiento sostenido. Estas adaptaciones se pueden considerar como fisiológicas y serían más notables en aquellos deportistas con una alta exigencia cardiovascular, como sucede en los que tienen un alto componente dinámico y moderado estático según la clasificación de Mitchell et al.21. Los mayores valores del diámetro de la aorta medido mediante ecocardiografía de los deportistas de resistencia son una evidencia indirecta de la adaptación de la aorta a la alta exigencia cardiovascular. Estudios en animales demuestran que las adaptaciones de la pared son consecutivas a fenómenos estructurales que se producen en la pared (cambios cuantitativos de los componentes), pero son de compleja explicación o justificación en seres humanos.
Conflicto de intereses
El autor declara no tener ningún conflicto de intereses.
Recibido el 23 de junio de 2016;
aceptado el 12 de septiembre de 2016
Disponible en Internet el 3 de diciembre de 2016
Correo electrónico: franciscojavier.calderon@upm.es