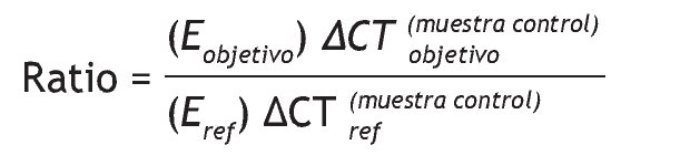El objetivo de este estudio fue investigar la respuesta al entrenamiento de resistencia de la expresión del ARNm del GLUT4 de los músculos sóleo y gastrocnemio en ratones obesos. Cuarenta ratones machos C57BL/6 fueron utilizados en este estudio. Ocho ratones (base normal [BN]) sirvieron como controles no obesos y no entrenados, y 32 ratones fueron sometidos a una dieta alta en grasa (DAG) (aumento del 60% de kcal) durante 12 semanas. En la semana 16 los ratones obesos fueron distribuidos aleatoriamente en los siguientes grupos de tratamiento (n = 8 cada grupo): obesos base (OB); baja intensidad (BI); alta intensidad (AI), o grupos de control de obesidad (CO). BI y AI fueron entrenados 5 días por semana durante 12 semanas en una cinta rodante motorizada a 15 m/min con una pendiente del 5% (en BI) y/o en 22 m/min en una pendiente del 5% (en AI). Los ratones CO se mantuvieron sedentarios en la jaula durante el programa de entrenamiento. La expresión del ARNm del GLUT4 se midió en los músculos gastrocnemio y sóleo, utilizando el método PCR en tiempo real. La expresión del ARNm del GLUT4 del músculo sóleo en el grupo BI aumentó aproximadamente 2,2 veces, frente a 1,6 veces en el gastrocnemio (p < 0,05). Además, la expresión de ARNm del GLUT4 en los músculos sóleo y gastrocnemio de los grupos BI y AI fue significativamente mayor que en OB y en los grupos CO (p < 0,05). Se puede concluir que cualquier alteración en el equilibrio energético del cuerpo, especialmente por el entrenamiento físico y/o una dieta alta en grasas, puede influir en los mecanismos moleculares y celulares que actúan para establecer una homeostasis estable.
The aim of this study was to investigate the expression of GLUT4 mRNA in soleus and gastrocnemius muscles in obese mice in response to endurance training. Forty male C57BL/6 mice were used in this study. Eight mice (normal base [NB]) served as non-obese non-trained controls, and 32 mice were put on a high fat diet (HFD) regimen (60% kcal fat) for 12 weeks. At week 16, the obese mice were randomized into the following treatment groups (n = 8 each group): obese base [OB]; low intensity [LI]; high intensity [HI], or obese control [OC] groups. LI and HI trained for 5 days/week for 12 weeks on a motorized treadmill at 15 m/min on a 5% slope (for LI), and/or at 22 m/min on a 5% slope (for HI). OC mice were kept sedentarily in the cage during the training program. GLUT4 mRNA expression was measured in gastrocnemius and soleus muscles using a Real Time-PCR method. GLUT4 mRNA expression of soleus muscle in LI group increased about 2.2 fold, against about 1.6 fold for gastrocnemius (P < .05). In addition, GLUT4 mRNA expression of soleus and gastrocnemius muscles in LI and HI groups were significantly higher than OB and OC groups (P < .05). It can be concluded that any disturbance in body energy balance, especially by exercise training and/or high fat diet, can influence these molecular and cellular mechanisms that act to establish a stable homeostasis.
Introducción
Por lo general se admite que la obesidad está fundamentalmente asociada a una alteración de la tasa de absorción de glucosa estimulada por la insulina en el músculo esquelético, que se ha atribuido a la resistencia a la insulina. Muchos estudios se han centrado en el sistema de transporte de la glucosa como parte de los mecanismos subyacentes. La glucosa transporta las células del músculo esquelético mediadas por las proteínas transportadoras de glucosa GLUT1 y GLUT41. Se cree que la isoforma GLUT1 es la transportadora de la glucosa que soporta el transporte de la glucosa basal2,3, mientras que la isoforma GLUT4 aumenta el transporte de glucosa en respuesta a la insulina y a la contracción. La insulina y las contracciones transportan el GLUT4 de la reserva intracelular a la membrana plasmática y a los túbulos T4,5.
Es sabido que en los roedores, la capacidad de absorción de la glucosa es mayor en los músculos oxidativos rojos que en los músculos glucolíticos blancos6-10. Parece que un mecanismo subyacente tiene un nivel mayor de expresión de GLUT4, tanto a nivel intracelular6,7 como en la membrana plasmática8. En el músculo esquelético humano la captación de glucosa se asocia positivamente a la proporción de fibras de tipo i y negativamente a la proporción de fibras de tipo iib11. Estos resultados se basan en el estudio in vitro de Zierath et al.12, quienes reportaron que el aumento de insulina estimulada en la captación de la glucosa por encima del nivel basal se correlaciona fuertemente, tanto afirmativamente con el porcentaje de fibras musculares de tipo I como negativamente con el porcentaje de fibras tipo IIa. Sin embargo, se han reportado resultados poco convincentes respecto a la relación entre la distribución del tipo de fibra y el contenido de GLUT4 en el músculo humano13-15. Andersen et al.13 no hallaron ninguna correlación entre tipo de fibra y contenido de GLUT4, mientras que Houmard et al.15 mostraron una baja correlación entre tipo de composición de la fibra y contenido de GLUT4.
Se ha demostrado que los distintos músculos presentan grandes diferencias en su contenido de GLUT4, y su variación está a menudo asociada a las diferencias en la captación de glucosa estimulada por la insulina16,17. Como los distintos músculos están compuestos por una combinación de distintos tipos de fibras musculares18, es posible que existan diferencias significativas en el contenido de GLUT4 entre músculos.
Posiblemente, las diferencias en el contenido de GLUT4 y la captación de la glucosa estimulada por la insulina están relacionadas con el nivel de entrenamiento. Los cambios del nivel de actividad del músculo esquelético son la clave reguladora del contenido de GLUT4 en ratones19,20. En los seres humanos, los deportistas tienen más GLUT4 que los sujetos control de igual edad no entrenados21,22, y en ambos, sujetos control normales y sanos e individuos con captación disminuida de la glucosa estimulada por la insulina, el entrenamiento físico ha demostrado que incrementa el contenido de GLUT420,23,24. Además, una disminución del nivel de actividad puede disminuir el contenido de GLUT420,25.
Finalmente, se ha manifestado que cambios en la actividad física y el contenido de GLUT4 están relacionados con cambios en la captación de glucosa estimulada por la insulina20.
El principal objetivo de este trabajo fue investigar la expresión del ARNm del GLUT4 en el sóleo (músculo predominantemente de contracción lenta) y el gastrocnemio (músculo predominantemente de contracción rápida) como respuesta al entrenamiento de resistencia en ratones obesos.
Sujetos y métodos
Animales
En este estudio se utilizaron 40 ratones machos C57BL/6 (de 4 semanas). Ocho ratones no obesos (base normal [BN]; dieta estándar alimentados ad libitum) sirvieron como controles no obesos no entrenados (el grupo BN se consideró como valor de referencia para el cálculo de la expresión génica en tiempo real que se expresa como valores relativos) y 32 ratones fueron sometidos a una dieta alimenticia alta en grasa (DAG) durante 12 semanas que consistió en el libre acceso a una dieta rica en grasas de 60% kcal (High-Fat Diet, Razi Vaccine & Serum Research Institute, Irán). En la semana 16, los ratones obesos fueron asignados aleatoriamente a los siguientes grupos de tratamiento (n = 8 cada grupo): 1) grupo base obeso [OB]; 2) grupo de baja intensidad [BI]; 3) grupo de alta intensidad [AI], o 4) grupo control obeso [CO]. Los ratones OB murieron antes del programa de entrenamiento. BI y AI entrenaron 5 días por semana durante 12 semanas en una cinta de correr motorizada. Los CO sirvieron como controles no entrenados. Todos los ratones fueron alojados en jaulas binarias; la temperatura de la sala de los animales se mantuvo a 22 °C, y se creó un ciclo artificial de 12 h de luz y 12 h de oscuridad. Se aplicó un período de familiarización de 2 semanas en las que los ratones corrían 7-10 m durante 10-15 min en una pendiente del 5%. Después, el entrenamiento se continuó en las 12 semanas siguientes, durante 60 min, de forma continua a 15 m/min en una pendiente del 5% (los BI) y/o 41 min continuamente a 22 m/min en una pendiente de 5% (los AI). El trabajo diario total fue igualado en ambos grupos y se fijó en 900 m la distancia de carrera. Los ratones CO se mantuvieron sedentarios en la jaula durante el programa de entrenamiento. El peso se registraba semanalmente. BI, AI y CO fueron sacrificados al final del programa de entrenamiento. La comida se les retiró 12-14 h antes de morir. Los experimentos fueron aprobados por el Comité de ética de investigación.
Preparación del músculo
Se anestesió a los ratones por vía intraperitoneal con una preparación de ketamina (30-50 mg/kg en perfusión continua [pc]) y xilacina (3-5 mg/kg pc) y murieron mediante extracción de sangre del corazón para tomar muestras del músculo 48 h después de la última sesión de ejercicio, y se disecaron los músculos sóleo y gastrocnemio. Las muestras de músculo se congelaron rápidamente en nitrógeno líquido y se conservaron a −80 °C. Los procedimientos de preparación de los tejidos y la extracción de ARN total están suficientemente descritos en varios estudios26.
PCR en tiempo real
Se usó ARN transcriptasa inversa o retrotranscripción y cebadores de hexámeros aleatorios según las instrucciones del fabricante (AccuPower Green Star qPCR PreMix, BiONEER, Daejeon, Corea). Luego, se añadieron PCR Master Mix que contenían cebadores específicos, ADN Taq Hotstar polimerasa y tampón de SYBR-Green PCR. Todas las muestras fueron determinadas como duplicado, y para un control negativo se utilizó la misma configuración, excepto en la adición de la transcriptasa inversa. No se detectó ningún producto de PCR en estas últimas condiciones.
Los niveles de ARNm de GLUT4 y β-actina, un gen de mantenimiento, se determinaron por transcripción inversa cuantitativa-PCR del ARN celular total usando el cebador directo 5´ CCG CGG CCT CCT ATG AGA TAC T3´ y el cebador reverso 5´ AGG CAC CCC GAA GAT GAG T3´ para la amplificación del RNAm del GLUT4 y el cebador directo 5´ ACA ATG AGC TGC GTG TGG CC 3´y el cebador reverso 5´ CCT CGT AGA TGG GCA CAG TG 3´ para la amplificación de β-actina ARNm. Los productos de amplificación se sometieron a electroforesis en geles de agarosa al 2% y se tiñeron con bromuro de etidio.
La cuantificación en tiempo real de GLUT4 a β-actina de ARNm se realizó mediante un ensayo de PCR SYBR-Green (Rotorgene 6000, Corbett). GLUT4 ARNm y β-actina de ARNm fueron amplificados en tubos separados y el protocolo de ciclado térmico de 40 ciclos consistió en la desnaturalización a 95 °C durante 20 s, hibridación a 60 °C durante 60 s, extensión a 72 °C durante 30 s que se inició con una desnaturalización inicial a 95 °C durante 15 min y se completó con una extensión final a 72 °C durante 10 min. Durante la etapa de extensión, el aumento de la fluorescencia fue medido en tiempo real. Los datos fueron obtenidos como valores CT (valor del ciclo umbral). La expresión génica relativa fue calculada con la fórmula de Pfaffl27:
Análisis de datos
Los valores se presentan como mediana ± DE. Se utilizó el análisis de varianza (ANOVA) de una vía seguido del test Honestly-significant-difference (HSD) de Tukey para evaluar los efectos del entrenamiento sobre la expresión relativa de ARNm de GLUT4 en diferentes grupos. También se utilizó el test t-apareado, para valorar la diferencia entre el ARNm del GLUT4 de los músculos sóleo y gastrocnemio en cada grupo. En todos los test se utilizó el software SPSS 21.0 (SPSS Inc., Chicago, IL, EE. UU.), y el valor de significación estadística se estableció en p ≤ 0,05.
Resultados
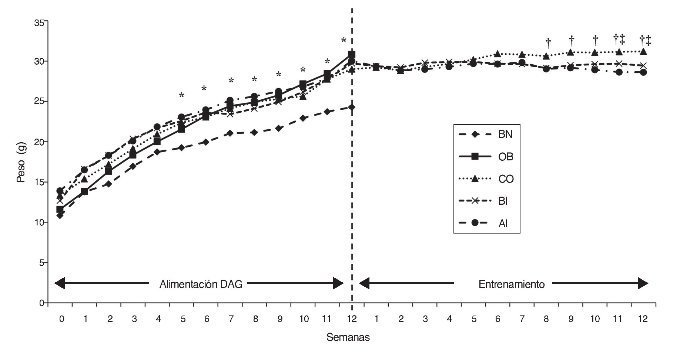
Los valores medios del peso de los ratones de diferentes grupos durante la dieta alta en grasa (DAG) y fases de entrenamiento se presentan en la figura 1. El peso de los grupos que consumieron DAG (es decir, OB, CO, BI y AI) aumentó significativamente en comparación con BN a partir de la quinta semana durante la fase DAG que se mantuvo alta hasta la semana 12 (p ≤ 0,05). El aumento de peso en los 4 grupos tratados fue del 18% de promedio en comparación con BN, que llegó al 32% en la duodécima semana (fig. 1).
Figura 1 Cambio de peso de ratones durante las fases de alimentación DAG y de entrenamiento. *: diferencia significativa entre los grupos de obesos y normal; †: diferencia significativa entre grupos de entrenamiento y OB; ‡: diferencias significativas entre los grupos AI/BI. AI: entrenamiento a alta intensidad; BI: entrenamiento a baja intensidad; BN: base normal; CO: control obeso; OB; obesos base.
Durante la fase de entrenamiento solo se estudiaron los grupos de entrenamiento (BI y AI) y CO, y la pérdida de peso de los grupos de entrenamiento comenzó a diferenciarse del grupo CO desde la sexta semana, y se convirtió en significativa a partir de la octava semana (p ≤ 0,05).
Por tanto, la pérdida de peso en los grupos de entrenamiento (en comparación con el grupo CO) fue del 5 y del 7% en la sexta y duodécima semana de la fase de entrenamiento, respectivamente. Es interesante señalar que la diferencia de la pérdida de peso entre BI y AI apareció a partir de la semana 9 y llegó a ser estadísticamente divergente en las semanas 11 y 12 (p ≤ 0,05). De hecho, la tasa de pérdida de peso fue mayor en AI que en BI, de modo que los cambios en el porcentaje de peso al final del entrenamiento de 12 semanas en el grupo AI fue 8% vs 5,5% en el grupo BI.
La expresión de ARNm del GLUT4 del músculo sóleo en los ratones que participaron en el grupo BI aumentó aproximadamente 2,2 veces, frente a ~ 1,6 veces del gastrocnemio, con relación a BN (p = 0,05); de manera similar, con respecto a la expresión de ARNm del GLUT4 se incrementó, aunque estadísticamente de manera no significativa, por la práctica de ejercicio de alta intensidad en los músculos sóleo y gastrocnemio ~ 2,1 y ~ 1,8 veces, respectivamente (p ≤ 0,05). Además, la expresión de ARNm del GLUT4 de los músculos sóleo y gastrocnemio en los grupos BI y AI fue significativamente mayor que en los grupos OB y CO (p ≤ 0,05), con una ligera regulación en descenso (down regulation) en los últimos grupos (fig. 2).
Figura 2 Contenido de ARNm de GLUT4 de los grupos experimentales gastrocnemio y sóleo en relación con el músculo emparejado en el grupo BN (p ≤ 0,05). *: aumento significativo con relación a BN; †: diferencia significativa en comparación con OB y CO (p ≤ 0,05).
Discusión
Ploug et al.28 encontraron que GLUT4 en fibras no estimuladas (por la insulina) se distribuía a lo largo de todas las fibras musculares, y estaba presente tanto en la superficie (68% del GLUT4 total) como en el núcleo (32% del GLUT4 total) de las fibras. También encontraron que los núcleos eran desplazados y alineados con los vasos sanguíneos que cursan a lo largo de la superficie de la fibra, que ocasionan una gran fracción de GLUT4 junto a la fuente de la glucosa evitando la necesidad de difusión a través de largas distancias. Está bien documentado que, en estado normal, GLUT4 circula lentamente entre la membrana plasmática y uno o más compartimentos intracelulares, con la gran mayoría de transportadores que residen en los compartimentos vesiculares dentro del interior de la célula28,29. La acumulación de insulina estimulada de la proteína GLUT4 en la superficie de la célula puede ser debida a un incremento de 10 a 20 veces de la tasa de exocitosis con una pequeña disminución (2-3 veces) de la tasa de endocitosis del GLUT445,10,30.
La insulina estimula el transporte de glucosa a través de la translocación de GLUT4 a partir de la agrupación de almacenamiento intracelular hacia la membrana plasmática.
La resistencia a la insulina causada por la falta de insulina o unos resultados anormales de señalización de la insulina con un descenso en la expresión y translocación de GLUT4 causa la hiperglucemia y la diabetes30-32. También se ha demostrado que la contracción muscular aumenta el contenido de GLUT4 de la membrana celular29,30. Varios estudios sugieren que el ejercicio físico causa la expresión de la proteína GLUT4 y la translocación en membrana plasmática mediante un mecanismo distinto de señalización de la insulina5,33. La mayoría de estudios sobre el músculo esquelético de ratones han indicado que hay más GLUT4 en las fibras de tipo i que en las de tipo II10,34, lo cual coincide con los resultados que hallamos en los ratones. En este estudio hemos utilizado solo el músculo sóleo, generalmente conocido como un músculo de fibras de tipo I.
Nuestro estudio concuerda con otros35-39 que han indicado que el ejercicio físico incrementa la expresión de la proteína GLUT4 en sujetos diabéticos, tal como sucedió en nuestros sujetos obesos.
Hallamos que la expresión de ARNm de GLUT-4 se incrementa con 12 semanas de entrenamiento de resistencia, en ambos músculos, en el sóleo (músculo en el que predominan las fibras de contracción lenta) y en el gastrocnemio (en que predominan las fibras de contracción rápida) en ratones obesos, con un patrón intenso de dependencia. Ello significa que la intensidad del ejercicio puede afectar a la expresión del gen GLUT-4 (y, probablemente, la proteína) en respuesta al entrenamiento, lo que puede provocar cambios metabólicos significativos especialmente en los casos obesos. En consonancia con nuestros resultados, se ha demostrado que la proteína GLUT-4 y el transporte de glucosa son notablemente superiores en las fibras musculares oxidativas rojas (tipos I y IIa) que en las fibras glucolíticas blancas (tipo IIb)10,40. Esto podría ser un factor importante en la adaptación al ejercicio, a causa de los resultados del entrenamiento de resistencia, en un cambio de fibras de tipo IIb a fibras tipo IIa41. Sin embargo, en los músculos esqueléticos humanos hay una diferencia mucho menor en la expresión de GLUT4 en diferentes tipos de fibras musculares34,42. Daugaard et al.34 aislaron fibras musculares individuales y las clasificaron según la isoforma de la miosonina. GLUT4 fue ~ 20% más alto en fibras que expresan la cadena pesada de la miosina I que en las que expresan la cadena pesada de la miosina IIa o IIb. No se pudieron detectar diferencias entre las fibras IIa y IIb. Tras 2 semanas de entrenamiento, GLUT-4 incrementó ~ 23% fibras musculares de tipo i, pero no hubo cambios en los tipos IIa o IIb. Sin embargo, el ejercicio de baja intensidad utilizado es conocido principalmente para reclutar fibras de tipo I.
De acuerdo con nuestros resultados, el entrenamiento de baja intensidad dio lugar a una mayor expresión de ARNm de GLUT4 en el músculo oxidativo (es decir, el sóleo), probablemente debido a los requisitos relacionados con la capacidad oxidativa de las células. Por otro lado, la práctica de ejercicio de alta intensidad no produjo una mayor expresión de ARNm de GLUT4 en el músculo sóleo, ni en el gastrocnemio. Como el músculo gastrocnemio consiste en una mezcla de fibras rojas y blancas, otra explicación sería que el entrenamiento con ejercicios de baja intensidad no bastó para ejercer o incluso activar las fibras rojas del músculo gastrocnemio, y un aumento no significativo de este músculo podría proceder de sus fibras blancas. Este escenario puede ampliarse a lo observado en los hallazgos relacionados con alta intensidad; es decir, un aumento no significativo en este músculo con el ejercicio de alta intensidad puede venir solamente de sus fibras rojas.
Las hormonas también regulan la concentración de la proteína del músculo transportador de la glucosa. La expresión de GLUT4 se incrementó debido a la insulina y las hormonas tiroideas20,43 y disminuyó por un AMPc elevado44. La regulación de la expresión de GLUT4 por la actividad contráctil es independiente de la regulación hormonal, ya que la carrera en la cinta de correr aumentó el GLUT4 en las ratas diabéticas45. Los efectos de la deficiencia de insulina y denervación en las concentraciones de GLUT4 fueron añadidos45. El entrenamiento físico también aumenta la proteína del GLUT4 y el ARNm muscular en pacientes con diabetes tipo 246. Estos resultados sugieren que la actividad contráctil del músculo modula directamente la expresión de GLUT4 del músculo, independientemente de la acción de la insulina. La histona deacetilasa 5 (HDAC5) es un media dor crítico de los cambios en los niveles de ARNm de GLUT4 en respuesta al entrenamiento47. Se ha demostrado que una serie de modificaciones de las histonas mediadas por la histona deacetilasa y la histona metiltransferasa culminarán en una caída metabólica del gen GLUT4 en el músculo esquelético de los ratones48.
Existen evidencias significativas de que los niveles de ARNm de GLUT4 disminuyen en el músculo del tejido adiposo con la obesidad49,50, y que el aumento de ARNm de GLUT4 puede aliviar o compensar la resistencia a la insulina51,52. Como se esperaba, nuestros hallazgos sobre los niveles de ARNm del GLUT4 aumentaron significativamente con el entrenamiento, y este incremento se asoció a una pérdida de peso, lo que respalda esta idea. Por lo tanto, el aumento de la transcripción de GLUT4 en el músculo durante la pérdida de peso puede ser una prueba definitiva en la reversión de la resistencia a la insulina.
Estudios anteriores, junto con nuestros hallazgos, sugieren que la regulación transcripcional del gen GLUT4 es sensible a cambios en el equilibrio de energía del cuerpo. Además, nosotros hallamos una respuesta de GLUT4 al entrenamiento dependiente de la intensidad y del tipo de fibra, que no se plantea en estudios previos.
Se puede concluir que cualquier alteración en el equilibrio energético del cuerpo, especialmente por la práctica de ejercicio y/o dieta alta en grasas, puede influir en los mecanismos moleculares y celulares tales que actúan para establecer una homeostasis estable. GLUT-4 podría disminuir si se aumentara la ingesta de energía y, a la inversa, aumentaría si se aumentara el gasto energético. Estos cambios son casi similares en los músculos de concentración lenta y rápida, con un poco más de capacidad de respuesta en los músculos de contracción lenta, porque están más comprometidos en el metabolismo de la glucosa.
Conflicto de intereses
Los autores declaran que no tienen ningún conflicto de intereses.
Agradecimientos
Los autores agradecen a la Universidad de Guilán el apoyo económico a este proyecto de investigación.
Recibido el 10 de octubre de 2015;
aceptado el 14 de diciembre de 2015
* Autor para correspondencia.
Correo electrónico: mohebbi-h@yahoo.com (H. Mohebbi).