La utilización de ayudas ergogénicas (farmacológicas y nutricionales) en el deporte, como los inmunomoduladores, está indicadas para reducir los efectos nocivos del daño muscular y la inflamación producidos por el ejercicio intenso, acompañados de un estado de fatiga. Estas ayudas, al acelerar el proceso de recuperación, son importantes para mejorar el rendimiento mediante la prevención de las respuestas perjudiciales frente a ejercicio extenuante modulando los procesos homeostáticos de adaptación que conducen a la recuperación y remodelación muscular. Con el uso de estas ayudas, se produciría un aumento de la carga de entrenamiento que podría ser tolerado por los deportistas. Esto, además de ser beneficioso para su rendimiento competitivo, también es un elemento importante a considerar como mecanismos para preservar la salud del deportista. Por último recordar que estos requerimientos extras deberán ser evaluados y recomendados por un profesional idóneo.
Ergogenic (pharmacological and nutritional) aids in sport, such as immunomodulators would be useful for reducing the harmful effects of muscle injury and inflammation, as well as in statees of fatigue. These aids, on accelerating the recovery process, could be important for improving performance by preventing damaging responses to exhausting exercise and modulating the homeostatic adaption processes which lead to recovery and remodelling. With the use of these aids, the increase in training load that could be tolerated by athletes, which would also be very beneficial for their performance, is also an important aspect to consider, as well as mechanisms to preserve the health of the athlete. Finally, remember that these extra requirements should be evaluated and recommended by a suitable professional.
El daño muscular inducido por el ejercicio y su corolario clínico del «daño muscular acumulado» (DOMS) resultan a menudo por el predomino del ejercicio excéntrico. La lesión es en sí misma una perturbación mecánica para los sarcómeros secundaria a una respuesta inflamatoria1,2,3,4,5,6. La PGE2 causa directamente la sensación de dolor, mientras que los leucotrienos aumentan la permeabilidad vascular y atrae a los neutrófilos al sitio del daño. Esta es la sensación de inflamación de la que el deportista es consciente después de un duro entrenamiento7. Sin embargo, el otro tipo de inflamación muscular, derivada del daño muscular acumulado, que es frecuente en los deportistas de alto rendimiento, se produce 1–2 días después de una fuerte sesión de ejercicios y/o competición, sobre todo en ejercicios con alto componente excéntrico en la acción muscular, o por el sobreuso muscular, están relacionados con el DOMS1,7,8.
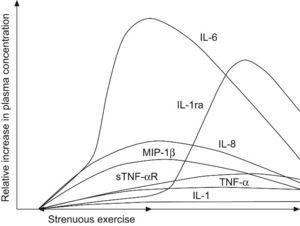
Efectos del ejercicio en la función inmuneEl ejercicio físico intenso y agudo se acompaña de respuestas que son notablemente similares en muchos aspectos a los que son inducidos por la infección, sepsis o traumatismo7. Se produce un aumento del número de leucocitos circulantes (principalmente linfocitos y neutrófilos), cuya magnitud se relaciona tanto con la intensidad y duración del ejercicio. También se producen aumentos en las concentraciones plasmáticas de diversas sustancias que influyen en las funciones de leucocitos, incluyendo citocinas inflamatorias, como el TNF-alfa, los macrófagos inflamatorios proteína-1 e IL-1; citocinas antiinflamatorias IL-6, IL-10, y la IL-1-antagonista del receptor (IL-1ra), y proteínas de fase aguda, incluyendo la proteína C-reactiva (PCR). Se ha demostrado que un aumento relativamente pequeño de los niveles plasmáticos de IL-6 induce aumentos de otras citocinas antiinflamatorias IL-1ra e IL-10, junto con la PCR. Durante el ejercicio, el aumento de la IL-6 precede al aumento de estas dos citocinas, argumentando que la IL-6 puede ser el iniciador de esta respuesta (Figura 1).
Figura 1. Respuesta de las citocinas frente al ejercicio.
Respuesta inflamatoria localEl daño muscular como resultado de contracciones excéntricas atrae a los leucocitos al lugar de la lesión. Los neutrófilos invaden el músculo esquelético durante varias horas (4h), y siguen presentes hasta 24h después del ejercicio2,9,10,11. Los neutrófilos y macrófagos contribuyen a la degradación del músculo dañado por la liberación de especies reactivas del oxígeno y de nitrógeno12, y también pueden producir citocinas proinflamatorias11,12. Las citocinas proinflamatorias interleucina (IL)-1β y el factor de necrosis tumoral (TNF)-α se expresan dentro del músculo hasta 5 días después del ejercicio13,14. La IL-1β y el TNF-α desempeñan un papel importante en el inicio de la destrucción del tejido muscular dañado13,14. Otras citocinas como IL-6 y el factor transformador del crecimiento (TGF)-β1, y los antígenos inflamatorios, como factor inhibidor de leucemia (LIF) y el factor inducible por hipoxia (HIF)-1β se expresan también en el músculo en los días siguientes el ejercicio excéntrico13,15. Por lo tanto, la respuesta inflamatoria local en el músculo esquelético después de ejercicio excéntrico es predominantemente proinflamatorias.
Respuesta inflamatoria sistémicaLos datos de estudios que analizan los cambios en las concentraciones de citocinas sistémicas después del ejercicio excéntrico son numerosos, por ello solo haremos mención a modo de resumen en lo que respecta a la respuesta de las citocinas sistémicas a diversos tipos de ejercicio excéntrico16,17. La carrera a intensidades ≥75% del VO2 máx provoca un mayor aumento en las concentraciones plasmáticas de IL-6, IL-1 y IL-1ra que otras formas de ejercicio excéntrico. Esta diferencia parece estar en relación con la intensidad y la duración del ejercicio, y posiblemente, por el aumento de la temperatura en lugar de daño muscular9,17.
Además, hay que considerar también que después del ejercicio excéntrico, se produce una fuerte reacción del sistema inmune antiinflamatorio, que afecta tanto a las concentraciones de las citocinas proinflamatorias como antiinflamatorias9,18. Las citocinas antiinflamatorias, como IL-4 e IL- 13 IL-1ra, IL-10 y los receptores solubles del TNF-α parecen ser producidos en las células mononucleares del sistema inmune19,20. Por lo tanto, aunque las respuestas proinflamatorias ocurren dentro de los músculos después del ejercicio excéntrico, la liberación de citoquinas proinflamatorias en la circulación parece también ser inhibida. El mecanismo de esta inhibición no está aclarado, pero según estudios realizados por Petersen et al20, parece ser que la IL-6 puede estar involucrada. Estos autores sugieren que la IL-6 actúa indirectamente para restringir la inflamación estimulando la producción de citocinas antiinflamatorias incluyendo IL-1ra, IL-10, el cortisol y el receptor soluble de TNF-α20. Después de correr una maratón, las concentraciones plasmáticas de TNF-α (2,3 ×), IL-1β (2,1 ×), IL-6 (128 ×) y la IL-10 (27 ×) se elevan inmediatamente después de la carrera. Sin embargo, los ascensos de los receptores solubles del TNF-α (~ 2 ×) y la IL-1ra (39 ×) se producen 1–1,5h más tarde21. Por tanto, como consecuencia del ejercicio excéntrico, se produce también un aumento de la circulación de citocinas antiinflamatorias y responder a la producción local de citocinas proinflamatorias para restringir la inflamación sistémica.
El ejercicio físico afecta tanto a la función celular como humoral del sistema inmune. Con el ejercicio físico se produce un aumento del número de linfocitos T y B, y una disminución del cociente T helper/T supresor (CD4/CD8)7. Los cambios de las células NK varían en función de la intensidad y duración del ejercicio, siendo los cambios más acusados en los ejercicios de larga duración que en los de corta12.
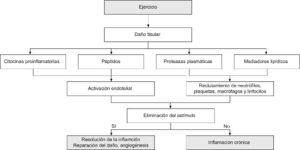
En este contexto de demanda celular y el estrés, se produce una atracción de células inflamatorias en el tejido muscular (Figura 2). Debido a la naturaleza global del sistema inmune, estos cambios locales tienen repercusiones significativas en los linfocitos y las células accesorias fuera del tejido muscular22, caracterizando a la respuesta inflamatoria inducida por el ejercicio en la que se origina infiltración de leucocitos y producción de citocinas proinflamatorias9,23. Pero además, en un sentido más amplio de la repercusión sistémica del daño muscular y la inflamación originados por el ejercicio, hay que tener en cuenta, que tras la realización de un ejercicio intenso y prolongado, se produce una situación de inmunosupresión denominada «ventana abierta», caracterizada por una disminución de la actividad de las células natural killer (NK), de las funciones de los neutrófilos, de los linfocitos T y B y de la concentración de IgA salivar que puede prolongarse aproximadamente 24h después de finalizar el ejercicio físico24,25,26,27,28. La gravedad de los daños y el curso temporal de los síntomas posteriores son dependientes tanto de las condiciones específicas del ejercicio como de los factores intrínsecos del individuo.
Figura 2. Mecanismos en la inflamación provocada por el ejercicio.
InmunomoduladoresAyuda ergogénica, es toda aquella sustancia o fenómeno que mejora el rendimiento. En esta revisión nos centraremos concretamente en el papel de los fármacos inmunomoduladores como el glycophosphopeptical (AM3) y un factor nutricional con reconocido papel inmunomodulador como es la glutamina.
Como consecuencia del daño muscular y la inflamación causada por el ejercicio, como acabamos de describir, se originan alteraciones y desajustes del sistema inmunológico acompañados de la «respuesta de fase aguda». Durante y después del ejercicio intenso, como ya hemos comentado, se produce un aumento de las citocinas proinflamatorias. Estas y otras citocinas median en una amplia gama de eventos metabólicos que afectan a todos los sistemas orgánicos en el cuerpo9,20,21,29.
Los inmunomoduladores que se considera que son potencialmente activos en la prevención o la recuperación de los cambios del sistema inmune asociado con la actividad deportiva competitiva incluyen inmunoglobulinas, glycophosphopeptical y la glutamina, aminoácido no esencial pero de gran importancia en la recuperación y regeneración muscular7,8,30,31.
Glycophosphopeptical (AM3)El AM3 es un inmunomodulador disponible en el mercado, con un perfil de baja toxicidad. Su ingrediente activo es un polisacárido de estructura compuesta, proteína purificada de Candida utilis, que tiene una amplia gama de efectos reguladores sobre la inmunidad innata y adaptativa en ratones y seres humanos32,33.
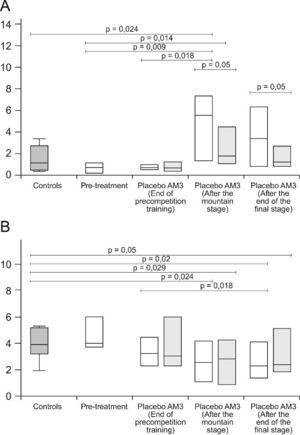
El AM3 inhibe parcialmente la producción del factor de necrosis tumoral (TNF α) y modula la producción de citocinas reguladoras (IL-1, IL-2, IL-12)32. En conjunto, estas modulaciones resultan en un efecto neto antiinflamatorio. Recientemente, nosotros hemos demostrado que AM3 es capaz de reducir y normalizar la concentración sérica de enzimas musculares en el deporte de competencia intensa y prolongada8,31. Este efecto bioquímico se asocia a una reducción de los niveles de citocinas proinflamatorias. Además, AM3 también muestra otros efectos inmunomoduladores como la estimulación de los macrófagos y la actividad de NK que pueden ser beneficiosos en deportistas de élite que son más susceptibles a las infecciones debido a la inmunosupresión crónica relacionada con el ejercicio y el estrés30,31,33. En nuestro estudio hemos puesto de manifiesto que el AM3 puede prevenir los ascensos en los niveles séricos de IL-6 inducidos por el ejercicio (carrera ciclista) (medida a 4h después de la carrera)31. Además, el entrenamiento previo a la competición se asocia con una reducción en los niveles de receptores solubles del TNF, mientras que la competición generó un aumento significativo en sus niveles, pero sin un aumento concomitante en el TNFα. Por tanto, el uso potencial de este immnunomodulador en la prevención de los desajustes inmunológicos y el daño tisular asociado a la práctica deportiva intensa puede ser de gran utilidad. Por tanto, el uso de estos fármacos podrían reducir las alteraciones metabólicas, inmunológicas y musculares asociadas al ejercicio físico intenso y mantenido (Figura 3A y B).
Figura 3. A) Cambios de la IL-6. B) TNF-α, tras una etapa de montaña en ciclistas profesionales tratados con AM3 durante 90 días.
GlutaminaLa glutamina es un aminoácido no esencial que promueva el crecimiento muscular y disminuye la inmunodepresión inducida por el ejercicio34. El músculo esquelético es el tejido más involucrado en la producción de glutamina, lo cual afecta a la provisión de glutamina al sistema inmune, por lo que la actividad de los músculos esqueléticos puede influi directamente en el sistema inmune. La glutamina aumenta los niveles plasmáticos después de un ejercicio a corto plazo, pero disminuye después de un ejercicio prolongado y exigente35,36 y de ahí que se ha formulado la hipótesis de que esta disminución en la disponibilidad de glutamina podría dañar la función inmune. La glutamina es uno de los principales estimuladores de las heat shock protein (HSP), un complejo de protección celular frente a injurias determinadas37. En este mismo sentido Wischmeyer38 hizo una revisión que planteó conceptos interesantes sobre las HSP; la glutamina sería un regulador de estas proteínas de protección celular.
Los períodos de entrenamiento muy intensos y prolongados se asociaron con una reducción crónica de las concentraciones plasmáticas de glutamina y se ha sugerido que esto puede ser en parte responsable de la inmunodepresión evidente en muchos atletas de resistencia37. La concentración intramuscular de la glutamina está relacionada con la velocidad de síntesis proteica neta39. Sin embargo, los mecanismos subyacentes a estos supuestos efectos anabólicos de la glutamina quedan por dilucidar. Se cree que la glutamina disminuye y atenúa la respuesta de citocinas, probablemente a través del factor NF-κB, es decir, modula el estímulo inflamatorio.
Con el ejercicio físico intenso puede disminuir la tasa de liberación de glutamina del músculo esquelético y/o aumentar la tasa de absorción de la glutamina por otros órganos o tejidos que utilizan glutamina (hígado, riñones), lo que limita la disponibilidad de glutamina para las células del sistema inmune40. La glutamina neutraliza el efecto catabólico o de la destrucción del tejido celular causado por el estrés. Durante el estrés, como el originado por el ejercicio, se produce un aumento de la concentración de cortisol en la sangre lo que conduce a la proteólisis de las proteínas musculares y aumento de la liberación de glutamina40. La glutamina juega un papel fundamental en el la recuperación muscular, en el aumento de masa muscular, fuerza y recuperación41. Además, un aumento de la L-alanina, L-citrulina, L-histidina y L-arginina se ha observado tras la administración de L-glutamina junto con un aumento en la tasa de aminoácidos ramificados (BCAA), lo que facilita la absorción por los músculos, promoviendo también la recuperación y el crecimiento de nuevas fibras musculares42. Parry-Billings et al43 han demostrado que la reducción en el nivel de glutamina (in vitro) por debajo de 600mmol/l se asocian con reducción de la síntesis de ARN, la producción de IL-2, la síntesis de inmunoglobulina y las respuestas proliferativa a mitógenos en linfocitos, y una disminución de la fagocitosis en los macrófagos.
Por todo lo comentado, y por no hacer más extensa la discusión, parece indudable que la glutamina ayuda a mantener un buen estado de salud (Tabla 1). De ahí que el consumo de suplementos de glutamina puede ser beneficioso en la prevención de inmunodepresión después del ejercicio, además de por su posible papel en el fomento de los procesos anabólicos, incluyendo glucógeno muscular y la síntesis de proteínas. Antonio et al44 han indicado que la ingestión a corto plazo de glutamina no mejora el rendimiento en el levantamiento de pesas de hombres entrenados, sugiriendo que su indicación es a largo plazo. Si que está claro y bien estudiado que el ejercicio intenso durante períodos prolongados puede causar una disminución en los niveles sanguíneos de glutamina, asociado con la fatiga y el sobreentrenamiento y otros estados catabólicos. En este sentido, Agostini y Biolo45, indican que después del ejercicio, se produce una reducción de la disponibilidad de glutamina por lo que la glutamina puede ser considerada como un marcador de sobreentrenamiento. Una adecuada disponibilidad de glutamina puede contribuir a disminuir la inflamación y aumentar los beneficios para la salud asociados al entrenamiento óptimo. Por lo tanto, la suplementación con glutamina puede mejorar la inmunocompetencia sistémica.
Tabla 1. Razones por las cuales es importante aportar glutamina
|
Los autores declaran no tener ningún conflicto de intereses.
Recibido 17 Mayo 2010
Aceptado 10 Junio 2010