Introducció: La fisiopatologia de la tendinopatia rotular no és encara prou coneguda. És difícil obtenir mostres clíniques d’esportistes que permetin conèixer la progressió de la tendinopatia, sobre tot en les primeres etapes. Per això, el propòsit d’aquest estudi fou desenvolupar, en una primera fase, un model experimental de tendinopatia rotular en rates, que simuli la tendinopatia humana, mitjançant l’aplicació in vivo de col·lagenasa en la porció proximal del tendó rotular.
Material i mètodes: El model experimental utilitzat foren rates Wistar mascles de 8 setmanes d’edat (n = 4). L’administració de col·lagenasa es realitzà, després d’anestesiar i immobilitzar els animals, mitjançant punció guiada per ecografia a nivell de la porció proximal i profunda del tendó rotular. La lesió tendinosa s’avaluà 48 h després de la lesió mitjançant ressonància magnètica; després es procedí a l’eutanàsia dels animals i a l’extracció dels tendons rotulars per fer-ne la valoració histològica.
Resultats: El model de lesió induïda amb col·lagenasa demostrà similitud a nivell de la histologia amb la tendinopatia rotular humana en la regió de la inserció proximal.
Conclusions: El model experimental de tendinopatia rotular en rates indueix la degeneració i distorsió de l’arquitectura de la porció proximal del tendó rotular, similar a l’observada en la tendinopatia rotular humana, i representa un model preclínic excel·lent per estudiar noves teràpies enfocades al tractament de la tendinopatia.
Introduction: Patellar tendon pathophysiology is not still fully understood. The collection of clinical samples from athletes that could permit the analysis of the tendinopathy progression, especially in the early stages, is difficult. For that reason, the purpose of this study is to develop a new experimental animal model of patellar tendinopathy in rats which mimics the human tendinopathy by in vivo intratendinous collagenase injection in the proximal portion of the patellar tendon.
Material and methods: The experimental model used was 8-week-old male Wistar rats (n = 4). The administration of collagenase was performed by ultrasound-guided puncture at the level of the proximal and deep portion of the patellar tendon in anesthetized animals. The tendon lesion was evaluated 48 h after injury by magnetic resonance and then, the animals were euthanized and the patellar tendons were collected for histological evaluation.
Results: The collagenase-induced lesion model demonstrated important similarities with the human patellar tendinopathy in the region of the proximal insertion.
Conclusions: The experimental model of patellar tendinopathy in rat model induces a degeneration and distortion of the patellar tendon architecture in its proximal portion, which closely mimics to that seen in human patellar tendinopathy, and could represent an excellent preclinical model for the study of new therapies focused on treatment of tendinopathy.
Introducció
La tendinopatia rotular fou descrita per primera vegada per Blazina el 1973 com a «genoll del saltador»1. És una patologia freqüent que afecta la inserció proximal del tendó rotular i és una de les formes més comunes de tendinopatia crònica en esportistes2. Tot i que s’han proposat nombroses teories, les causes de la fisiopatologia de la tendinopatia rotular encara són poc conegudes3,4.
Cook i Purdam5 proposaren un model basat en el contínuum de la patologia tendinosa. El model considera 3 fases que poden sobreposar-se i interconnectar-se al llarg del temps: tendinopatia reactiva, deteriorament del tendó (fallada del procés de cicatrització) i tendinopatia degenerativa. Aquest model proposa que la càrrega de treball del tendó exerceix un paper essencial a l’inici i en la progressió de la tendinopatia5. Els resultats trobats comunament en esportistes són una tendinopatia degenerativa, caracteritzada per un augment de la matriu no col·làgena (proteoglicans), degeneració mucoide amb fibrosi variable, neovascularització i augment de la celul·laritat deguda als fibroblasts6. D’altra banda, Fu et al.7 també proposaren un model de tres etapes caracteritzat per una lesió inicial, un procés de cicatrització i una manifestació clínica ineficaç. Malgrat la importància clínica de la tendinopatia, la seva fisiopatologia i l’evolució clínica encara són poc conegudes, cosa que en limita les intervencions terapèutiques. Els avenços en el coneixement i la comprensió de l’evolució clínica de la tendinopatia presenten limitacions importants, no sols a nivell d’obstacles per obtenir mostres de teixit humà d’esportistes, sinó també degut a què aquestes mostres només representen les etapes finals dels processos patològics amb un inici i durada no revelats8-10. Per aquest motiu, s’han proposat diversos models amb animals per estudiar la tendinopatia, tot i que les similituds amb la tendinopatia humana i la seva idoneïtat per estudiar la fisiopatologia del tendó rotular encara són controvertides11-13.
S’han descrit diversos models animals per estudiar la tendinopatia rotular, com les lesions del tendó induïdes quirúrgicament14-22, la injecció intratendinosa de col·lagenasa23-34, administrant substàncies biològiques35,36 o induïdes per sobrecàrrega37-39; tanmateix, la majoria s’utilitzen per verificar els abordatges terapèutics i només alguns són utilitzats per descriure els mecanismes patològics de la tendinopatia rotular. Per aquest motiu el present treball proposa la creació d’un nou model animal capaç de reproduir la tendinopatia rotular de la porció proximal profunda que s’observa comunament en esportistes. Aquest model pot permetre estudiar i comprendre l’evolució patològica de la tendinopatia en la porció proximal, així com avaluar l’efectivitat de noves intervencions terapèutiques per fomentar els processos de regeneració del tendó rotular.
Material i mètodes
Animals
El model animal experimental utilitzat foren rates Wistar mascle de 8 setmanes (Harlan). S’empraren un total de 4 animals. Les rates es mantingueren a 22-24 °C en cicles de 12 h de llum/foscor, amb accés sense límit a menjar i aigua. Tots els procediments es dugueren a terme d’acord amb la legislació espanyola (Reial Decret 53/2013) i europea (2010/63/EU) i aprovats pel Departament d’Agricultura, Ramaderia, Pesca, Alimentació i Medi Natural del Govern català (Generalitat de Catalunya).
Model de lesió basat en la col·lagenasa
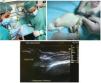
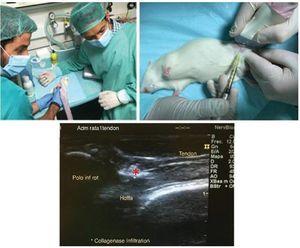
Els animals van ser anestesiats mitjançant injecció intraperitoneal d’una mescla de ketamina (75 mg/kg) i xilazina (10 mg/kg) i col·locats en posició supina, amb l’articulació del genoll esquerre cap amunt, abans del procediment quirúrgic. El procés quirúrgic de producció de la lesió del tendó rotular s’il·lustra a la figura 1. Prèviament s’afaità l’articulació del genoll i s’esterilitzà amb alcohol al 70%. La lesió del tendó es generà mitjançant injecció guiada per ultrasò d’una solució de col·lagenasa al 10% dissolta en solució salina prèviament filtrada per a esterilització amb un filtre de 0,22 µm (Nalgene), amb una agulla de 29 G (0,33 mm de diàmetre intern). La intervenció es realitzà al costat anterior del genoll, inserint l’agulla a la porció proximal del tendó fins arribar a les fibres profundes. Una vegada arribada a l’àrea seleccionada, s’alliberaren 20 µl de solució de col·lagenasa a l’àrea d’inserció proximal del tendó (fig. 1). Després de la intervenció quirúrgica, s’administrà analgèsia postquirúrgica (buprenorfina 0,01 mg/kg) per via subcutània a tots els animals. El nostre estudi seguí els estàndards ètics de l’esport i la recerca en ciències de l’esport40.
Figura 1 Model de lesió basat en l’aplicació de col·lagenasa. S’administrà una dosi de col·lagenasa a la regió proximal profunda del tendó rotular amb infiltració guiada per ultrasò (*).
Anàlisi mitjançant ressonància magnètica
Es realitzaren estudis de ressonància magnètica 1H in vivo a la Universitat Autònoma de Barcelona (UAB, Barcelona, Espanya) usant BioSpec 70/30 USR (7T) de Bruker (Bruker Bio-Spin GmbH, Ettlingen, Alemanya) amb un miniequip de ressonància amb gradient (400 mT/m) i una bobina transceptora de quadratura de 72 mm de diàmetre intern.
Es col·locaren les rates en un llit, cosa que facilità subministrar l’anestèsia (isoflurà, 1,5-2,0% en O2 a 1 l/min), amb un circuit integrat d’aigua calenta per regular la temperatura corporal. La temperatura corporal es mesurà amb un sonda rectal i es mantingué a 37 ± 1 °C. Es controlà la freqüència respiratòria amb una sonda de pressió que es mantingué entre 60 i 80 respiracions/min. Inicialment s’obtingueren imatges ràpides d’eco d’spin de baixa resolució, calibrades en T2, en plans axial, sagital i coronal per a ser utilitzades com imatges scout de referència. Els paràmetres d’imatge d’aquestes imatges foren: temps d’eco efectiu (TEeff) = 36 ms; temps de repetició (TR) = 3 s; longitud del tren d’ecos (ETL) = 8; camp de visió (FOV) = 6 × 6 cm2; grandària de la matriu (MTX) = 128 × 128; grossària dels talls (ST) = 2 mm; separació entre talls (gap) = 0,5 mm; nombre de talls d’imatges (NS) = 25 axials, 10 sagitals, 11 coronals; nombre de mitjanes (NA) = 1. S’obtingueren imatges de l’eco d’spin ràpid d’alta resolució en T2 en plans sagitals que contenien la lesió i el costat contralateral. Els paràmetres experimentals d’aquestes imatges foren: TEeff = 30 ms; TR = 4 s; ETL = 8; FOV = 3,2 × 3,2 cm2; MTX = 256 × 256; ST = 1 mm; gap = 0,1 mm; NS = 18; NA = 12; temps experimental = 25 min 36 s. Les dades de ressonància magnètica s’obtingueren i foren processades en un ordinador amb el sistema operatiu Linux mitjançant el programari Paravision 5.1 (Bruker BioSpin GmbH, Ettlingen, Alemanya) (fig. 2).
Figura 2 Durant les proves de ressonància magnètica es monitorà la temperatura i la freqüència cardíaca als animals anestesiats. S’obtingueren imatges sagitals en alta resolució de seqüències ràpides espin eco ponderades en T2 dels tendons rotular i contralateral lesionats.
Anàlisi histològica
Els animals van ser sacrificats 7 dies després de la lesió amb administració intraperitoneal d’una sobredosi de ketamina (75 mg/kg) i xilazina (10 mg/kg). Immediatament se’ls van extreure els tendons d’ambdues cames des de la ròtula a la inserció de la tíbia, incloent-hi el coixinet de greix de Hoffa. Les mostres es congelaren en 2-metilbutà (Alfa Aesar, Johnson Matthey Company, Karlsruhe, Alemanya) prèviament sobrerefredades en nitrogen líquid, i emmagatzemades a −80 °C fins a ser utilitzades. Les mostres de tendó es seccionaren longitudinalment (10 µm de gruixària) utilitzant un criotom (Leica Microsystems, Wetzlar, Alemanya) a −20 °C i es muntaren en un portaobjectes de Polilisina® (VWR, Lovaina, Bèlgica). Per a l’anàlisi histològica s’utilitzaren seccions consecutives de tendons congelats. Es realitzà la tinció de les mostres amb hematoxilina-eosina (1 min d’hematoxilina i 15 s d’eosina), es rentaren amb aigua i es deshidrataren amb solucions de gradient d’etanol (1 × 50% d’etanol, 2 × 70% d’etanol, 2 × 90% d’etanol, 2 × 100% d’etanol, 1 min cada un) i s’esbandiren amb xilè (5 s). Després d’assecar-los amb aire, es muntaren els portaobjectes en un mitjà DPX i un cobreobjectes (VWR, Madrid, Espanya). S’obtingueren microfotografies a través d’un microscopi BX-61 (Olympus) equipat amb una càmera DP72 (Olympus) i el programari de tractament digital d’imatges CellSens® (versió 1.9).
Resultats
Anàlisi de la lesió del tendó rotular mitjançant ressonància magnètica
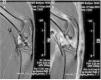
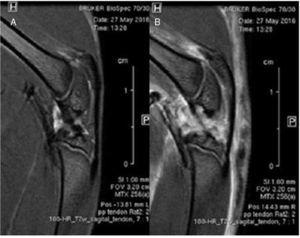
Es compararen imatges sagitals mitjançant ressonància magnètica de tendons rotulars sans i lesionats. No es detectaren diferències d’alineament o gruixària de les fibres tendinoses al llarg del teixit del tendó. S’observà edema difós que afectava principalment les estructures articulars i musculars (fig. 3).
Figura 3 Estudi comparatiu mitjançant ressonància magnètica. No es van trobar diferències en l’estructura del tendó rotular sa (A) i el tendó lesionat (B).
Anàlisi macroscòpica de la lesió del tendó
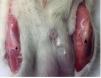
Es trobaren diferències macroscòpiques clares entre tendons sans i lesionats. Així, el tendó sa evidenciava un color blanc brillant i intens i una consistència forta, mentre que el tendó lesionat presentava un color marró groguenc i una aparença gelatinosa. S’observà que els teixits periarticulars, principalment els músculs esquelètics adjacents, presentaven canvis de color i consistència (fig. 4).
Figura 4 Anàlisi microscòpica. Comparació del tendó sa (esquerre) i del lesionat (dret). El tendó lesionat té un color marró groguenc i una aparença gelatinosa (fletxa i punta de fletxa).
Anàlisi histològica del tendó rotular
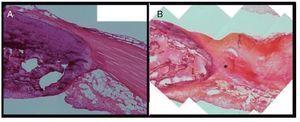
El tendó contralateral sa mostrà un aspecte uniforme, presentant fibres de col·lagen compactes i ben alineades. Els tenòcits mostraven forma de fus i es localitzaven en parallel a la mostra de fibres tendinoses. L’estructura del greix de Hoffa mostrà característiques normals. En canvi, en el tendó lesionat s’observà clarament una degeneració de l’estructura de la fibra de col·lagen, mostrant també una estructura ondulada evident i espais buits entre els feixos de fibres adjacents a nivell del terç proximal del tendó rotular. També s’observà una fragmentació parcial de les fibres del tendó al lloc de la injecció. Igualment, es detectà una desorganització clara del coixinet de greix de Hoffa, cosa que en suggereix l’afectació i l’alteració com a conseqüència de l’administració de col·lagenasa (fig. 5).
Figura 5 Estudi histològic comparatiu del tendó sa (A) i el lesionat (B). El tendó lesionat presenta degeneració de l’estructura del col·lagen al lloc de la punció (*).
Discussió
La troballa principal d’aquest estudi fou demostrar la similitud de les alteracions estructurals del tendó rotular de les rates tractat amb col·lagenasa, caracteritzat per la desorganització de les fibres de col·lagen i estructures adjacents, respecte a la tendinopatia rotular observada en la clínica dels humans. Aquests resultats suggereixen que l’administració d’una única dosi de col·lagenasa infiltrada mitjançant ecografia guiada és eficaç per a reproduir exactament els canvis estructurals en la integritat de la regió proximal del tendó rotular de la tendinopatia rotular humana.
Per primera vegada, es generà un model animal que imita la degeneració del teixit tendinós en el lloc anatòmic més comú observat en la tendinopatia rotular humana. S’han desenvolupat altres models animals de tendinopatia per a induir la degeneració tissular en la part medial del terç del tendó rotular a través d’una «finestra» creada quirúrgicament14-22. Aquest mecanisme de lesió no reprodueix la lesió detectada en la clínica humana, ja que els defectes creats quirúrgicament es generen en àrees tendinoses diferents del lloc més comú on es produeix la patologia tendinosa, per a la qual cosa es planteja la hipòtesi que els mecanismes de reparació del tendó d’aquests models no reprodueixen la patologia del tendó sotmès a càrregues de treball repetitives35,38. El nostre model està orientat a imitar la degeneració de les fibres proximals profundes, ja que tant la biomecànica com la relació de la regió proximal del tendó rotular amb les estructures adjacents, principalment amb el coixinet de greix de Hoffa, són importants no sols per a la progressió de la tendinopatia, sinó també en els processos de cicatrització del tendó39,40.
Es considera que la càrrega de treball excessiva del tendó durant un entrenament físic intens és la causa principal de la degeneració patològica41. Per aquesta raó, s’ha utilitzat l’entrenament com un model que indueix la tendinopatia rotular36,42,43. El principal inconvenient d’aquesta tècnica rau en la necessitat de passar un llarg període de temps en entrenar els animals per tal de desenvolupar els canvis patològics característics de la tendinopatia rotular humana. Creiem que fora interessant crear un model combinat de degeneració del tendó rotular basat en una lesió inicial mitjançant injecció intratendinosa a base de col·lagenasa a la regió profunda proximal seguida d’un període d’entrenament físic intens amb la finalitat d’induir més ràpidament la degeneració patològica característica del tendó rotular. Dades prèvies sobre els models de tendinopatia d’Aquil·les generats per l’administració de col·lagenasa guiada per ecografia pot conduir a tendinopatia en rates i que l’elastasa també pot estar implicada en el desenvolupament de la tendinopatia crònica44.
El nostre estudi té algunes limitacions. La primera és la petita quantitat d’animals (n = 4) utilitzada a l’estudi. En segon lloc, caldria optimitzar la dosi de col·lagenasa per reproduir exactament els canvis característics de la tendinopatia rotular humana i prevenir el dany col·lateral d’estructures adjacents al tendó. Perucca Orfei et al.45 generaren un model en el tendó d’Aquil·les de les rates que reprodueix exactament els canvis histològics observats en la tendinopatia d’Aquil·les en humans i avaluaren l’efecte de dues dosis de col·lagenasa administrada intratendinosa (1 i 3 mg/ml). Tot i que ambdues dosis induïren la desorganització de les fibres de col·lagen i l’augment de la cel·lularitat, el tractament amb major dosi de col·lagenasa pogué induir una neovascularització major i degeneració del greix, canvis que també depenen de la durada. Al nostre estudi no s’observaren aquests canvis, ja que el temps transcorregut des de l’administració de col·lagenasa a l’anàlisi dels tendons fou més curt. A més, Perucca Orfei et al. presentaren el tendó mitjançant una incisió longitudinal de la pell, mentre que nosaltres vam utilitzar una tècnica mínimament invasiva basada en l’aplicació de col·lagenasa guiada per ecografia per induir tendinopatia a la regió de les fibres proximals profundes específiques del tendó rotular amb la pertorbació mínima de les estructures i teixits de l’articulació del genoll. D’altra banda, la nostra anàlisi realitzada mitjançant ressonància magnètica demostra que l’efecte de la col·lagenasa no es localitza exclusivament a nivell del tendó sinó que també podria afectar les estructures periarticulars, circumstància que no ha estat discutida en estudis previs.
En resum, el nostre estudi suggereix que l’administració d’una solució de col·lagenasa guiada per ecografia en la regió proximal profunda del tendó rotular podria representar un model coherent per reproduir la degeneració i els canvis habitualment vistos en la tendinopatia rotular en humans. Aquest nou model també ens ha de permetre desenvolupar noves teràpies adreçades a millorar i curar la tendinopatia rotular com a pas previ per iniciar assajos clínics en pacients humans.
Finançament
Aquest article no ha tingut cap font de finançament.
Conflicte d’interessos
Els autors declaren que no tenen cap conflicte d’interessos directament relacionat amb el contingut d’aquest article.
Agraïments
Els autors agraeixen al Departament de Cirurgia de la Facultat de Medicina de la Universitat Autònoma de Barcelona (UAB). En el moment de la redacció d’aquest estudi, David Domínguez era estudiant de doctorat de la UAB i aquest treball forma part de la seva tesi doctoral, realitzada a l’esmentat Departament sota la direcció i supervisió del Dr. Gil Rodas i el Dr. Mario Marotta.
Rebut el 22 de desembre de 2016; acceptat l’11 de gener de 2017
* Autor per a correspondència.
Correu electrònic:david.dominguez@fcbarcelona.cat (D. Domínguez)